Građa atoma
| Sjedište: | CARNET - Arhiva 2021 Loomen |
| E-kolegij: | Građa tvari |
| Knjiga: | Građa atoma |
| Otisnuo/la: | Gost (anonimni korisnik) |
| Datum: | subota, 27. prosinca 2025., 21:57 |
Opis
Što su atomi i kako su građeni saznaj u ovaj knjizi!
1. Uvod
Zadatak:
Uzmi komad papira i pokidaj ga na sve manje i manje dijelove. Kako dugo možeš kidati taj papir?
U ovoj ćeš knjizi pronaći odgovor na prethodno pitanje i na mnoga druga. Upoznat ćeš građu tvari. Naučit ćeš kako se zovu najmanje čestice tvari, kako su izgrađene, koje vrste subatomskih čestica postoje i kakva su im svojstva. Nakon završetka teme znat ćeš definirati protonski i nukleonski broj i spoznati gdje se takve čestice mogu primjeniti.
Dakle, dijelimo li neku tvar na sve manje i manje dijelove doći ćemo da najmanje, najsitnije čestice koja se više neće moću podijeliti. Na sličan su način razmišljali, još u antičko doba, Leukip i Demokrit pa su takvu česticu nazvali atomom. (grč.athomos - nedjeljiv)

2. Model atoma
Atome zamišljamo kao kuglice i prikazujemo različitim modelima, poput ovog na slici:

U atomu postoje 3 vrste čestica: protoni, neutroni i elektroni. Jednim imenom zovemo ih subatomske čestice. Međusobno se razlikuju po naboju i masi. Protoni imaju pozitivan, elektroni negativan, a neutroni su bez naboja.
Koliko se pojedinih subatomskih čestica nalazi u atomu na slici?
[Broj čestica označavamo s N. Broj protona označavamo N(p); broj elektrona N(e-) a broj neutrona N( n )]
N (p) = 3
N (e-) = 3
N( n ) = 4
Prouči sliku i svoje odgovore te odgovori: Koliki je ukupni naboj atoma? Obrazloži svoj odgovor!
2.1. Model atoma
U svakom atomu jednak je broj protona i elektrona i zbog toga je atom uvijek neutralna čestica. Znači,
N(p) = N(e-)= Z
Broj koji pokazuje koliko se protona nalazi u nekom atomu zove se protonski ili atomski ili redni broj, a označuje se sa Z.
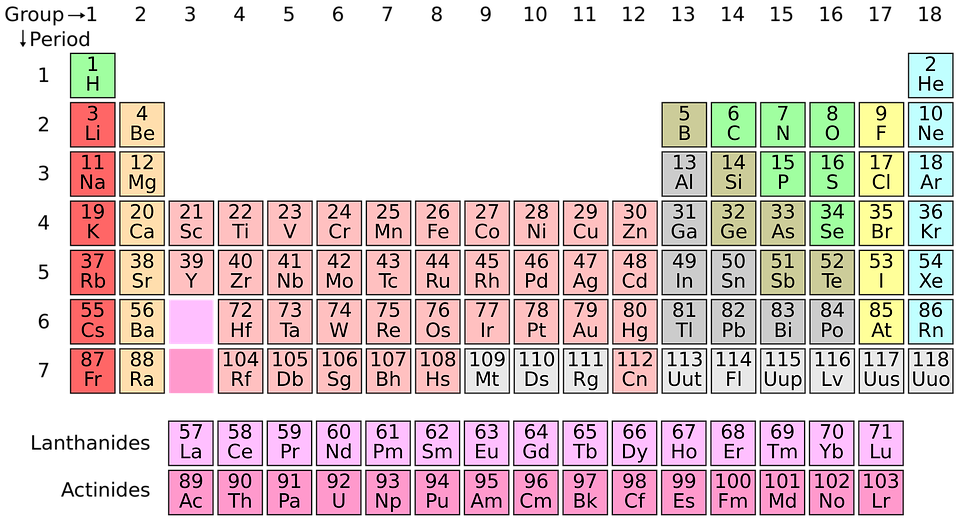
Odredi protonski broj za atom sa slike! Čiji je to atom? (odgovor ćeš pronaći služeći se periodnim sustavom elemenata)
2.2. Model atoma
(Rješenje: Z = 3)
Broj neutrona ne možemo saznati iz protonskog broja. Znači, atom mora imati još jedan broj a taj se zove nukleonski ili maseni, a označava se s A. Nukleoni su čestice koje se nalaze u jezgri (nukleusu) atoma.
Prema tome, kako bi definirali nukleonski broj?
A= N (p) + N( n )
Nukleonski ili maseni broj je broj koji pokazuje koliko se protona i neutrona nalazi u nekom atomu.
Probaj objasniti zbog čega se nukleoski broj zove još i maseni broj?
Uz simbol atoma nekog elementa (označen općenitom oznakom X) možemo upisati protonski i maseni broj:
A
X
z
3. Ponovi!
Koristeći sljedeću poveznicu
https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_hr.html
probaj napraviti modele sljedećih atoma:
a) ugljika
b) kisika
c) vodika